2025.3.14
- 開発の舞台裏
化粧品・医薬部外品の原料開発はどう行う?
煩雑な申請手続きについて解説!

化粧品や化粧品原料の開発、販売を行うにあたっては、安全性試験、安定性試験などの評価や、薬事申請の行政手続きが必要です。
しかし、どういった試験を行えばいいのか等、専門メーカーでないとわからないことも多くあり、戸惑うことも多いでしょう。
そこで三省製薬では、原料開発から処方開発、製造、販売まで一貫して行っているメーカーだからこそ持つ長年のノウハウをもとに、お悩みの企業様の課題を解決する開発サポート業務を行っております。
原料開発から処方開発、販売支援まで幅広く対応可能
三省製薬は自社製品の原料開発から処方開発、製造、販売まで行っているため、すべての工程における数々の経験と知識があります。その経験と知識を活かし、原料・処方開発から製造までの一貫でのご依頼はもちろん、安定性試験や有効性試験などの部分的なご依頼もお受けしております。
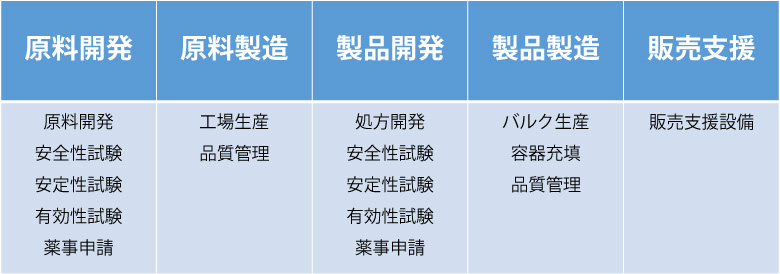
これまでにも、原料や製品の開発を自社で行われた後、自社で実施できない評価や試験を三省製薬にご依頼いただくというケースが数多くございました。このような開発サポート業務のうち、今回は薬事申請に焦点をあててご紹介いたします。
新規の原料を含むか否かで手順が異なる
製品開発は、新規の原料を含む製品を開発する場合と、既存の原料のみで開発する場合の2通りに分けられます。それぞれ必要な項目が異なり、前者の場合、その新規原料を製品に配合できるよう手順を踏む必要があるため、ここからは新規の原料を含む製品を開発する場合についてご説明します。
新規の原料を含む製品開発
まず注意しなければならないのは、その原料を「化粧品原料」として開発していくか「医薬部外品原料」として開発していくか、という点です。同じような商品に見えても、「化粧品」と「医薬部外品」の区分が違えば、準備作業も大きく異なります。
化粧品とは
化粧品は一部の規制された原料を除き、製造販売元の責任のもと、製造販売届出をするだけで製造販売が可能です。
医薬部外品と比較すると販売までの時間を短縮でき、使用できる原料の幅も広いという利点があります。
一方で人体に対する作用は緩和なもので、効能は定められた範囲でなければなりません。
医薬部外品とは
医薬部外品は厚生労働省が効果・効能を認めた有効成分を一定の濃度で配合し、厚生労働省から承認を得ることで製造販売が可能となります。化粧品よりも具体的な効能効果を有するため、より確実にお悩みに応える製品にすることが出来ます。
しかし、使用できる原料が限られているほか、原料によっては配合量にも制限があります。また、製品毎に厚生労働省からの承認を得なくてはならないため、化粧品に比べて開発に時間がかかるというデメリットがあります。
では、三省製薬では実際にどのような流れで開発を進めていくのか、それぞれのケースを見ていきましょう。
化粧品原料として開発を行うケース

新しい化粧品原料を開発する際には、以下のような手順を踏む必要があります。
1.INCI名の取得
- ● Personal Care Products Council(米国パーソナルケア製品評議会)に申請
- ● 取得までに3〜6ヶ月程度必要
- ● 国際的に認められた成分名称として必須
2.化粧品表示名称の取得
- ● 日本化粧品工業会(粧工会)に申請
- ● 日本国内での表示に使用
こうして名称を取得した原料は、安全性や安定性等の検証もしっかりと行った上で、化粧品に配合できるようになります。
ここで気を付けたいのは、化粧品原料では美白などの効能効果を謳う製品には配合できないということです。美白などの特別な効能を謳うものは「医薬部外品」に当たり、非常に厳しい規制があります。これは多くの方が見落としがちなポイントです。
なぜ美白製品には特別な規制があるのか
美白製品は「医薬部外品」として扱われ、使用できる原料が限定されています。これは以下の理由によります。
- ● 美白(メラニンの生成を抑える等)などの効能効果は、肌の機能に影響を与える作用
- ● 安全性と有効性の厳密な確認が必要
- ● 消費者保護の観点から、規制による管理が必須
新規原料を医薬部外品に配合するためには、化粧品よりも煩雑な手続きをしなければなりません。
医薬部外品原料として開発を行うケース
新しい医薬部外品原料を開発する際には、以下のような手順を踏む必要があります。
1.外原規(医薬部外品原料規格)との適合確認
- ● 既存の規格への適合性チェック
- ● 実際の試験による確認作業
- ● 適合すれば医薬部外品への配合が可能
2.別紙規格の申請(外原規に適合しない場合)
- ● 新規の医薬部外品原料として申請
- ● 詳細な安全性試験データの提出
- ● 申請から承認まで1年以上必要
医薬部外品原料の開発には、予想以上の投資が必要です。これは多くの企業が直面する重要なポイントです。
なぜそれほどコストがかかるのか
医薬部外品原料の開発には、なぜこれほどの投資が必要なのでしょうか?
その理由は、開発過程の複雑さと厳格さにあります。まず、開発費用については都心のファミリーマンション相当の予算が必要となります。これは、複数の安全性試験を実施する必要があり、それぞれの試験に多大なコストがかかるためです。
その上、開発期間も1年以上、場合によっては数年に及ぶことがあり、その間の人件費や設備維持費なども考慮する必要があります。さらに、各段階で専門家による評価や確認作業が必要となり、これらの専門的なサービスにもコストがかかります。
そして、医薬部外品原料とするだけでなく、新規原料自体を効能効果が謳える有効成分として開発するには、これよりも上をいく非常に大掛かりな申請が必要となり、掛かる時間もコストも大幅に増えることになります。
開発者が知っておくべきこと
このような状況を踏まえ、開発者は以下の2つの重要なポイントを理解しておく必要があります。
第一に、化粧品原料としての開発と医薬部外品原料としての開発は、まったく異なるプロセスを経ることです。
第二に、別紙規格を取得できたとしても、効果効能を謳うためにはさらなる申請が必要となります。ただし、これらのハードルを乗り越えた先には大きな可能性が待っています。
まとめ
「化粧品」と「医薬部外品」のように、ちょっとした違いのように感じても、開発をスタートしてから実際に配合するまではまったく内容が異なる場合があります。どんな手続きが必要なのか、どのくらいのコストがかかるのか、時間はどのくらい見たらいいのか。そんな疑問の数々は、ぜひ三省製薬にお尋ねください。これまでの知識と経験を活かし、しっかりと開発のサポートをいたします。





